Transportproteine
Transportproteine, lokalisiert in Plasmamembranen, spielen eine entscheidende Rolle für die Aufnahme, Verteilung und Exkretion von endogenen Substanzen und von körperfremden Stoffen wie Arzneimitteln. Man unterscheidet Transporter, welche die Aufnahme in Zellen und solche, welche den Export aus Zellen vermitteln. Aufnahmetransporter gehören zur Superfamilie der SLC-Transporter (SLC = Solute Carrier) wohingegen viele Exportproteine zur Superfamilie der ABC-Transporter (ABC = ATP-binding Cassette) gehören und Substanzen unter ATP-Hydrolyse gegen einen Konzentrationsgradienten transportieren können. Am Lehrstuhl für Klinische Pharmakologie und Klinische Toxikologie untersuchen wir Transportproteine, welche Arzneimittel als Substrate erkennen und deshalb an der Pharmakokinetik von Arzneimitteln beteiligt sind. Mit Hilfe verschiedener in vitro Zellmodelle versuchen wir, die Relevanz dieser Arzneimitteltransporter für die Pharmakotherapie zu ermitteln. Dabei kommen folgende Modelle zum Einsatz:
Einzeltransfizierte Zellmodelle mit der rekombinanten Überexpression eines Arzneimitteltransporters. Diese Zellmodelle werden dann verwendet wenn untersucht werden soll, ob ein Arzneimittel ein Substrat oder ein Inhibitor eines Transportproteins ist. Basis dieser Zellmodelle sind HEK293-Zellen (HEK = Human Embryonic Kidney), welche nach Transfektion den gesuchten Transporter rekombinant überexprimieren (z.B. HEK-OATP1B1).
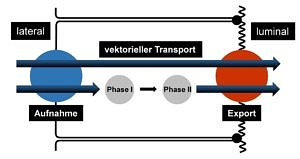
Mehrfachtransfizierte Zellmodelle mit der rekombinanten Überexpression eines Aufnahmetransporters und eines Exportproteins. Basis dieser Zellmodelle sind polar-wachsende MDCKII-Zellen (MDCK = Madin Darby Canine Kidney) welche nach doppelter Transfektion einen Aufnahmetransporter in der basolateralen Membran und ein Exportprotein in der luminalen Membran überexprimieren (z.B. MDCK-OATP1B1-MRP2). Diese Zellmodelle erlauben die Analyse sogenannter vektorieller Transportvorgänge bei denen das Zusammenspiel von Aufnahme und Export parallel in einem Modell untersucht wird.
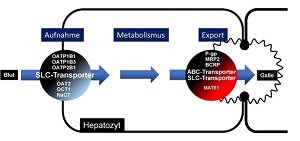
Die Leber ist ein Hauptorgan für die Elimination von endogenen Stoffwechselmetaboliten und von Xenobiotika (z.B. Arzneimittel). Hierbei ist die Aufnahme der Substanzen über die basolaterale Membran eine unabdingbare Voraussetzung für deren anschließenden Metabolismus und Export in die Galle. Weiterhin ist der Hepatozyt auch Wirkort vieler Arzneimittel (z.B. von HMG-CoA-Reduktase Inhibitoren, den sogenannten Statinen). Deshalb kommt Transportproteinen in Hepatozyten eine wichtige Rolle für die Pharmakokinetik von Arzneimitteln zu. Am Lehrstuhl für Klinische Pharmakologie und Klinische Toxikologie untersuchen wir deshalb Transportproteine, für die eine pharmakologische Relevanz nachgewiesen wurde. Hierzu gehören neben den Aufnahmetransportern der SLCO/SLC21-Familie (OATP1B1, OATP1B3 und OATP2B1) auch Mitglieder der SLC22-Familie(OAT2 und OCT1) sowie das Exportprotein des SLC47-Familie MATE1. Weiterhin stehen auch ABC-Transporter im Fokus des Interesses (P-Glykoprotein, MRP2 und BCRP), welche in der kanalikulären Membran lokalisieren. Es können folgende Forschungsfelder angeführt werden:
Welche Rolle spielen Transportproteine bei transportervermittelten Arzneimittelinteraktionen? Diese Fragestellung wird meist mit einzeltransfizierten Zellmodellen untersucht, bei denen das zu untersuchende Transportprotein rekombinant überexprimiert wird.
Was sind die funktionellen Konsequenzen genetischer Variationen in Transportergenen (Polymorphismen und Haplotypen) für den Transport von Arzneimitteln und endogenen Substraten? Zur Untersuchung dieser Fragestellung stehen mehrere Zellmodelle zur Verfügung, welche eine mutierte Variante des Transportproteins überexprimieren (z.B. OATP1B1p.V174A / OATP1B1*5).
Wie gestaltete sich das Zusammenspiel von Aufnahme, Metabolismus und Export? Zur Untersuchung dieser Fragestellung stehen mehrere mehrfach-transfizierte Zellmodelle zur Verfügung, die neben einem Aufnahmetransporter zusätzlich eine Exportpumpe (sogenannte Doppeltransfektanten; z.B. MDCK-OATP1B1-MRP2) oder Enzyme des Metabolismus (MDCK-OATP1B1-CYP3A1-UGT1A1-MRP2) parallel stabil überexprimieren. Mit den Doppeltransfektanten können in vektoriellen Transportuntersuchungen parallel die Aufnahme über die basolaterale und der Export über die apikale (kanalikuläre) Membran in einem Zellmodell analysiert werden. Diese Zellmodelle werden immer dann zu Untersuchungen herangezogen, wenn die Transportuntersuchungen im Rahmen der hepatobiliären Elimination von endogenen Substanzen oder Arzneimitteln analysiert werden sollen.
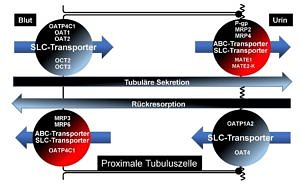
Neben der Leber ist die Niere das Hauptorgan für die Elimination von körpereigenen Substanzen und von Xenobiotika (z.B. Arzneimittel). Forschungsgegenstand unseres Lehrstuhls sind Transportproteine, exprimiert in den proximalen Tubuluszellen, welche für die tubuläre Sekretion körpereigener Substanzen und Arzneimitteln aus dem Blut in den Urin als auch für die Rückresorption von Substanzen aus dem Urin verantwortlich sind. Schwerpunkt sind hierbei folgende Fragestellungen:
Wie gestaltet sich das Zusammenspiel von Aufnahme über die basolaterale Membran und Export über die luminale Membran während der renalen Exkretion endogener Substanzen und von Arzneimitteln. Für Untersuchungen dieser Fragestellung werden vor allem mehrfachtransfizierte Zellmodelle (z.B. MDCK-OCT2-MATE1 oder MDCK-OATP4C1-P-gp) herangezogen.
Welche Rolle spielen Transportproteine bei der renalen Homöostase von Argininderivaten. Hier steht mit dem OATP4C1-Protein das einzige SLC21/SLCO-Familienmitglied im Fokus des Forschungsinteresses, welche in humanen proximalen Tubuluszellen der Niere exprimiert wird.
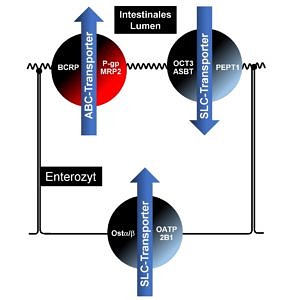
Viele zugelassene Arzneimittel sind Substrate des Effluxtransporters P-Glykoprotein. P-Glykoprotein ist im Darm in der luminalen Enterozytenmembran exprimiert. Es limitiert dadurch die Resorption von P-Glykoproteinsubstraten aus dem Darmlumen. Ziel unserer Arbeiten ist es, die Bedeutung von P-Glykoprotein bei Arzneimittelwechselwirkungen noch besser zu verstehen.
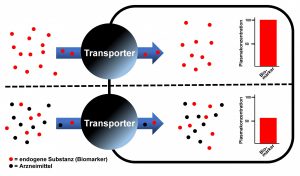
Im Rahmen der Zulassung von Arzneimitteln wird bislang aufgrund unzureichender in vitro – in vivo-Prädiktionen eine zu große Anzahl von Interaktionsstudien an gesunden Freiwilligen durchgeführt. Ziel ist es die Anzahl solcher Untersuchungen durch Verwendung endogener Moleküle als Biomarker für Transporter-vermittelte Arzneimittel-Wechselwirkungen zu reduzieren. Idealerweise wird ein solcher Biomarker bei der erstmaligen Anwendung neuer Wirkstoffe am Menschen im Plasma gemessen. Mögliche Änderungen seiner kinetischen Parameter weisen bei einem gut charakterisierten Biomarker darauf hin, dass bei dem neuen Wirkstoff Transporter-vermittelte Wechselwirkungen zu erwarten sind. Eigene Untersuchungen beschäftigen sich unter anderem mit der endogenen Substanz N1-Methylnicotinamid als potentiellem Biomarker für Interaktionen über renale Kationentransporter (Müller F et al., Eur J Clin Pharmacol, 2015, 71: 85-94). Eine Übersichtarbeit der Arbeitsgruppe stellt die Datenlage zu potentiellen Biomarkern dar und fasst u.a. Kriterien für valide Biomarker zusammen (Müller F et al., Pharmacol Rev, 2018, 70: 246-277).
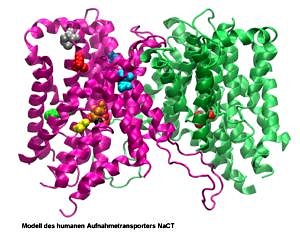
Neben ihrer Bedeutung für die Kinetik von Arzneimitteln kommt Transportproteinen eine wichtige Rolle für die Verteilung und Exkretion körpereigener Substanzen zu. So sind verschiedene pathologische Zustände mit einer geänderten Transportfunktion eines Transportproteins assoziiert. Wir untersuchen aktuell das SLC13-Familienmitglied NaCT (SLC13A5 / INDY), welches eine wichtige Rolle beim Transport von Intermediaten des Citratzyklus spielt und dessen genetischer Defekt zu Formen der frühkindlichen epileptischen Enzephalopathie (EIEE) führt. Ein weiteres Forschungsprojekt befasst sich mit dem renal-exprimierten Transportprotein OATP4C1 und seiner Rolle beim Transport von Urämietoxinen (z.B. Asymmetrisches Dimethylarginin – ADMA) sowie des Argininderivats und Biomarkers L-Homoarginin.
Genetische Variationen in Transportergenen spielen eine wichtige Rolle bei interindividuellen Arzneimittelwirkungen oder sie sind verantwortlich für hereditäre Erkrankungen. Ein Hauptziel unserer Arbeiten ist, die funktionellen Konsequenzen genetischer Variationen (SNPs = Single Nucleotide Polymorphisms – Einzelnukleotidpolymorphismen oder Haplotypen) in Genen, kodierend für Arzneimitteltransporter zu charakterisieren. Dies geschieht unter Verwendung von Expressionsplasmiden, bei denen durch gerichtete Mutagenese der Basenaustausch (die Basenaustausche) eingeführt werden, die nach Translation zu Mutationen im Arzneimitteltransporter führen. Diese Plasmide werden dann verwendet um in Transportversuchen (transient oder mit stabil-transfizierten Zellmodellen) die Auswirkungen der Mutation(en) auf den Transport ausgewählter Arzneimittel zu untersuchen.
Ein weiterer Forschungsschwerpunkt ist die Analyse von Mutationen im SLC13A5-Gen, kodierend für den Aufnahmetransporter NaCT (INDY). Dieser Transporter spielt eine wichtige Rolle beim Energiemetabolismus, aber auch für die Gehirnentwicklung und Mutationen im SLC13A5-Gen können zum Krankheitsbild der frühkindlichen epileptischen Enzephalopathie führen.
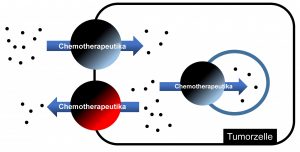
Bei einer Tumortherapie kommt Transportproteinen eine wichtige Rolle bei der Resistenzvermittlung gegenüber eingesetzten Chemotherapeutika zu. So konnte gezeigt werden, dass die Überexpression bestimmter ABC-Transporter (z.B. P-Glykoprotein) durch den vermehrten Austransport oder durch den Transport der Chemotherapeutika in intrazelluläre Vesikel zu einer Resistenz gegenüber diesen Arzneimitteln führt. Auch Aufnahmetransporter scheinen dabei eine wichtige Rolle zu spielen, z.B. indem diese in ihrer Expression herunterreguliert werden und somit Chemotherapeutika als Substrate dieser Transporter nicht mehr in Tumorzellen aufgenommen werden. Ziel unserer Arbeiten ist es, die Rolle von Transportproteinen bei der Resistenzvermittlung gegenüber Chemotherapeutika besser zu verstehen.
Weiterhin untersuchen wir aktuell (in einem von der Wilhelm Sander-Stiftung geförderten Forschungsprojekt) eine Variante des hepatischen Aufnahmetransporters OATP1B3 (das Ct-OATP1B3-Protein = Cancer-Type OATP1B3), welche vor allem in verschiedenen Tumorgeweben exprimiert wird. Mit Hilfe verschiedener Methoden (Transportassays, Expressionsanalysen, Zytotoxizitätsassays, Proteomics und untargeted Metabolomics) werden Untersuchungen zum Substratspektrum, zur Lokalisation und Regulation, zu pathophysiologischen Mechanismen sowie zur klinischen Relevanz beim kolorektalen Karzinom durchgeführt.
Surrer DB, Schüsser S, König J, Fromm MF, Gessner A. Transport of aromatic amino acids L-tryptophan, L-tyrosine, and L-phenylalanine by the organic anion transporting polypeptide (OATP) 3A1.
FEBS J, 2024, 291: 4732-4743
Gessner A, König J, Wenisch P, Heinrich MR, Stopfer P, Fromm MF, Müller F. New biomarkers for renal transporter-mediated drug-drug interactions: metabolomic effects of cimetidine, probenecid, verapamil, and rifampin in humans.
Clin Pharmacol Ther, 2024, 117: 130-142
Sponfeldner MI, Andrikyan W, Maas RM, Fromm MF. Pseudo-worsening of kidney function due to inhibition of renal creatinine secretion: quality of information provided in Prescribing Information/SmPC.
Clin Pharm Ther, 2024,116: 1259-1268
Nies AT, König J, Leuthold P, Damme K, Winter S, Haag M, Masuda S, Kruck S, Daniel H, Spanier B, Fromm MF, Bedke J, Inui K-i, Schwab M, Schaeffeler E. Novel drug transporter substrates identification: An innovative approach based on metabolomic profiling, in silico ligand screening and biological validation.
Pharmacol Res, 2023, 196, 106941
Gessner A, Müller F, Wenisch P, Heinrich MR, König J, Stopfer P, Fromm MF. A metabolomic analysis of sensitivity and specificity of 23 previously proposed biomarkers for renal transporter-mediated drug-drug interactions.
Clin Pharmacol Ther, 2023, 114: 1058-72
Müller F, Hohl K, Keller S, Schmidt-Gerets S, Deutsch B, Schuler-Metz A, Fromm MF, Stopfer P, Gessner A. N1-methylnicotinamide as biomarker for MATE-mediated renal drug-drug interactions: impact of cimetidine, rifampin, verapamil, and probenecid.
Clin Pharmacol Ther, 2023, 113: 1070-1079
Türk D, Müller F, Fromm MF, Selzer D, Dallmann R, Lehr T. Renal transporter-mediated drug biomarker interactions of the endogenous substrates creatinine and N1-methylnicotinamide: a PBPK modeling approach.
Clin Pharmacol Ther, 2022, 112: 687-698
Misaka S, Ono Y, Taudte RV, Hoier E, Ogata H, Ono T, König J, Watanabe H, Fromm MF, Shimomura K. Exposure of fexofenadine, but not pseudoephedrine, is markedly decreased by green tea extract in healthy volunteers.
Clin Pharmacol Ther, 2022, 112: 627-634
Uddin ME, Eisenmann ED, Li Y, Huang KM, Garrison DA, Talebi Z, Gibson AA, Jin Y, Nepal M, Bonella IM, Fu Q, Sun X, Millar A, Tarason M, Jay CE, Cui X, Einolf HJ, Pelis RM, Smith SA, Radwanski PB, Sweet DH, König J, Fromm MF, Carnes CA, Hu S, Sparreboom A. MATE1 deficiency exacerbates dofetilide-induced proarrhythmia.
Int J Mol Sci, 2022, 23: 8607
Surrer DB, Fromm MF, Maas R, König J. L-arginine and cardioactive arginine derivatives as substrates and inhibitors of human and mouse NaCT/Nact.
Metabolites, 2022, 12: 273
Haberkorn B, Fromm MF, König J. Transport of drugs and endogenous compounds mediated by human OCT1: studies in single- and double-transfected cell models.
Front Pharmacol, 2021, 12: 662535
Nies AT, König J, Hofmann U, Kölz C, Fromm MF, Schwab M. Interaction of remdesivir with clinically relevant hepatic drug uptake transporters.
Pharmaceutics, 2021, 13: 369
Wiebe ST, Giessmann T, Hohl K, Schmidt-Gerets S, Hauel E, Jambrecina A, Bader K, Ishiguro N, Taub ME, Sharma A, Ebner T, Mikus G, Fromm MF, Müller F, Stopfer P. Validation of a drug transporter probe cocktail using the prototypical inhibitors rifampin, probenecid, verapamil and cimetidine.
Clin Pharmacokinet, 2020, 59: 1627-1639
Hanke N, Türk D, Selzer D, Ishiguro N, Ebner T, Wiebe S, Müller F, Stopfer P, Nock V, Lehr T. A comprehensive whole-body physiologically based pharmacokinetic drug-drug-gene interaction model of metformin and cimetidine in healthy adults and renally impaired individuals.
Clin Pharmacokinet, 2020, 59: 1419-1431
Taghikhani E, Maas R, Taudte RV, Gessner A, Fromm MF, König J. Vectorial transport of the arginine derivatives asymmetric dimethylarginine (ADMA) and L-homoarginine by OATP4C1 and P-glycoprotein studied in double-transfected MDCK cells.
Amino Acids, 2020, 52: 975-985
Misaka S, Abe O, Ono T, Ono Y, Ogata H, Miura I, Shikama Y, Fromm MF, Yabe H, Shimomura K. Effects of single green tea ingestion on pharmacokinetics of nadolol in healthy volunteers.
Br J Clin Pharmacol, 2020, 86: 2314-2318
Fischer O, Hofmann J, Rampp H, Kaindl J, Pratsch G, Bartuschat A, Taudte RV, Fromm MF, Hübner H, Gmeiner P, Heinrich M. Regiospecific introduction of halogens on the 2-aminobiphenyl subunit leading to highly potent and selective M3 muscarinic acetylcholine receptor antagonists and weak inverse agonists.
J Med Chem, 2020, 63: 4349-4369
Schumann, T, König J, Henke C, Willmes DM, Jordan J, Fromm MF, Birkenfeld AL. SLC transporters as potential targets for the treatment of metabolic disease.
Pharmacol Rev, 2020, 72: 343-379
Gessner A, König J, Fromm MF. Clinical aspects of transporter-mediated drug-drug interactions.
Clin Pharmacol Ther, 2019, 105: 1386-1394
Taghikhani E, Maas R, Fromm MF, König J. The renal transport protein OATP4C1 mediates uptake of the uremic toxin asymmetric dimethylarginine (ADMA) and efflux of cardioprotective L-homoarginine.
PLOS ONE, 2019, 14: e0213747
Deutsch B, Neumeister C, Schwantes U, Fromm MF, König J. Interplay of the organic cation transporters OCT1 and OCT2 with the apically localized export protein MATE1 for the polarized transport of trospium.
Mol Pharmaceut, 2019, 16: 510-517
Ceckova M, Reznicek J, Deutsch B, Fromm MF, Staud F. Efavirenz reduces renal excretion of lamivudine by inhibiting organic cation transporters (OCT, Oct) and multidrug and toxin extrusion proteins (MATE, Mate).
PLOS ONE, 2018, 13: e0202706
Müller F, Weitz D, Mertsch K, König J, Fromm MF. Importance of OCT2 and MATE1 for the cimetidine-metformin interaction: Insights from investigations of polarized transport in single- and double-transfected MDCK cells with a focus on perpetrator disposition.
Mol Pharmaceut, 2018, 15: 3425-3433
Selch S, Chafai A, Sticht H, Birkenfeld AL, Fromm MF, König J. Analysis of naturally occurring mutations in the human uptake transporter NaCT important for bone and brain development and energy metabolism.
Sci Rep, 2018, 8: 11330
Abe O, Ono T, Sato H, Müller F, Ogata H, Miura I, Shikama Y, Yabe H, Onoue S, Fromm MF, Kimura J, Misaka S. Role of (-)-epigallocatechin gallate in the pharmacokinetic interaction between nadolol and green tea in healthy volunteers.
Eur J Clin Pharmacol, 2018, 74: 775-783
Gessner A, König J, Fromm MF. Contribution of multidrug and toxin extrusion protein 1 (MATE1) to renal secretion of trimethylamine-N-oxide (TMAO).
Sci Rep, 2018, 8: 6659
Müller F, Sharma A, König J, Fromm MF. Biomarkers for in vivo assessment of transporter function.
Pharmacol Rev, 2018, 70: 246-277
Müller F, Weitz D, Derdau V, Sandvoss M, Mertsch K, König J, Fromm MF. Contribution of MATE1 to renal secretion of the NMDA receptor antagonist memantine.
Mol Pharmaceut, 2017, 14: 2991-2998
von Loeffelholz C, Lieske S, Neuschäfer-Rube F, Willmes DM, Raschzok N, Sauer IM, König J, Fromm MF, Horn P, Chatzigeorgiou A, Pathe-Neuschäfer-Rube A, Jordan J, Pfeiffer AFH, Mingrone G, Bornstein SR, Stroehle P, Harms C, Wunderlich FT, Helfand SL, Bernier M, de Cabo R, Shulman GI, Chavakis T, Püschel GP, Birkenfeld AL. The human longevity gene homolog INDY and interleukin-6 interact in hepatic lipid metabolism.
Hepatology, 2017, 66: 616-630
Chafai A, Fromm MF, König J, Maas R. The prognostic biomarker L-homoarginine is a substrate of the cationic amino acid transporters CAT1, CAT2A and CAT2B.
Sci Rep, 2017, 7: 4767
Taghikhani E, Fromm MF, König J. Assays for analyzing the role of transport proteins in the uptake and the vectorial transport of substances affecting cell viability.
Methods Mol Biol, 2017, 1601:123-135
Chen J, Brockmöller J, Seitz T, König J, Chen X, Tzvetkov, MV. Tropane and pyrrolizidine alkaloids as substrates and inhibitors of organic cation transporters of the SLC22 (OCTs) and SLC47 (MATEs) families.
Biol. Chem. 398, 2017, 237-249
Ceckova M, Reznicek J, Ptackova Z, Cerveny L, Müller F, Kacerovsky M, Fromm MF, Glazier JD, Staud F. Role of ABC and solute carrier transporters in the placental transport of lamivudine.
Antimicrob Agents Chemother, 2016, 60: 5563-5572
Gruetz M, Sticht H, Gläser H, Fromm MF, König J. Analysis of amino acid residues in the predicted transmembrane pore influencing transport kinetics of the hepatic drug transporter organic anion transporting polypeptide 1B1 (OATP1B1).
BBA Biomembranes, 2016, 1858: 2894-2902
König J, Fromm MF. Mehrfach transfizierte Zellmodelle zur Untersuchung des Zusammenspiels von Arzneimitteltransport und -metabolismus.
Doktor Robert Pfleger-Stiftung, 2016, Stiftungstätigkeiten in den Jahren 2011-2015, 41-49
Misaka S, Knop J, Singer K, Hoier E, Keiser M, Müller F, Glaeser H, König J, Fromm, MF. The non-metabolized β-blocker nadolol is a substrate of OCT1, OCT2, MATE1, MATE2-K and P-glycoprotein, but not of OATP1B1 and OATP1B3.
Mol Pharmaceut, 2016, 13: 512-519
Knop J*, Misaka S*, Singer K, Hoier E, Müller F, Gläser H, König J, Fromm MF. Inhibitory effects of green tea and (-)-epigallocatechin gallate on transport by OATP1B1, OATP1B3, OCT1, OCT2, MATE1, MATE2-K and P-glycoprotein.
PLOS ONE, 2015, 10: e0139370 (*authors contributed equally)
Knop J, Hoier E, Ebner T, Fromm MF, Müller F. Renal tubular secretion of pramipexole.
Eur J Pharm Sci, 2015, 79: 73-78
Hacker K, Maas R, Kornhuber J, Fromm MF, Zolk O. Substrate-dependent inhibition of the human organic cation transporter OCT2: A comparison of metformin with experimental substrates.
PLOS ONE, 2015, 10: e0136451
Bujok K, Gläser H, Schuh W, Rau TT, Schmidt I, Fromm MF, Mandery K. Interplay between the prostaglandin transporter OATP2A1 and prostaglandin E2-mediated cellular effects.
Cell Signal, 2015, 27: 663-72
Müller F, Pontones CA, Renner B, Mieth M, Hoier E, Auge D, Maas R, Zolk O, Fromm MF. N1-methylnicotinamide as an endogenous probe for drug interactions by renal cation transporters: studies on the metformin-trimethoprim interaction.
Eur J Clin Pharmacol, 2015, 71: 85-94
Huber S, Huettner JP, Hacker K, Bernhardt G, König J, Buschauer A. Esters of bendamustine are by far more potent cytotoxic agents than the parent compound against human sarcoma and carcinoma cells.
PLOS ONE, 2015, 10: e0133743
Gläser H, Bujok K, Schmidt I, Fromm MF, Mandery K. Organic anion transporting polypeptides and organic cation transporter 1 contribute to the cellular uptake of the flavonoid quercetin.
Naunyn-Schmiedeberg’s Arch Pharmacol, 2014, 387: 883-891
Misaka S, Yatabe J, Müller F, Takano K, Kawabe K, Gläser H, Yatabe MS, Onoue S, Werba JP, Watanabe H, Yamada S, Fromm MF, Kimura J. Green tea ingestion greatly reduces plasma concentrations of nadolol in healthy subjects.
Clin Pharmacol Ther, 2014, 95: 432-438
Lüneburg N, Lieb W, Zeller T, Chen MH, Maas R, Carter AM, Xanthakis V, Glazer NL, Schwedhelm E, Seshadri S, Ikram MA, Longstreth WT, FornageM, König IR, Loley C, Ojeda FM, Schillert A, Wang TJ, Sticht H, Kittel A, König J, Benjamin EJ, Sullivan LM, Bernges I, Anderssohn M, Ziegler A, Gieger C, Illig T, Meisinger C, Wichmann HE, Wild PS, Schunkert H, Psaty BM, Wiggins KL, Heckbert SR, Smith N, Lackner K, Lunetta KL, Blankenber S, Erdmann J, Münzel T, Grant PJ, Vasan RS, Böger RH. Genome-wide association study of L-arginine and dimethylarginines reveals novel metabolic pathways for symmetric dimethylarginine.
Circ Cardiovasc Genet, 2014, 7: 864-872
Misaka S, Müller F, Fromm MF. Clinical relevance of drug efflux pumps in the gut.
Curr Opin Pharmacol, 2013, 13: 847-852
Strobel J, Müller F, Zolk O, Endreß B, König J, Fromm MF, Maas R. Transport of asymmetric dimethylarginine (ADMA) by cationic amino acid transporter 2 (CAT2), organic cation transporter 2 (OCT2) and multidrug and toxin extrusion protein 1 (MATE1).
Amino Acids, 2013, 45: 989-1002
Müller F, König J, Hoier E, Mandery K, Fromm MF. Role of organic cation transporter OCT2 and multidrug and toxin extrusion proteins MATE1 and MATE2-K for transport and drug interactions of the antiviral lamivudine.
Biochem Pharmacol, 2013, 86: 808-815
König, J, Müller F, Fromm MF. Transporters and drug-drug interactions: important determinants of drug disposition and effects.
Pharmacol Rev, 2013, 65: 944-966
Fahrmayr C, König J, Auge D, Mieth M, Münch K, Segrestaa J, Pfeifer T, Treiber A, Fromm MF. Phase I and II metabolism and MRP2-mediated export of bosentan in a MDCKII-OATP1B1-CYP3A4-UGT1A1-MRP2 quadruple-transfected cell line.
Br J Pharmacol, 2013, 169: 21-33
Klatt S, Fromm MF, König J. The influence of oral antidiabetic drugs on cellular drug uptake mediated by hepatic OATP family members.
Basic Clin Pharmacol, 2013, 112: 244-250
Zolk O, Schnepf R, Muschler M, Fromm MF, Wendler O, Traxdorf M, Iro H, Zenk J. Transporter gene expression in human head and neck squamous cell carcinoma and associated epigenetic regulatory mechanisms.
Am J Pathol, 2013, 182: 234-243
König J, Fromm MF. Chapter 7: OATP1B1, OATP1B3 and OATP2B1.
Pharmacogenomics of human drug transporters: Clinical Impacts. Hrsg. Toshihisa Ishikawa, Richard B. Kim, Jörg König, 2013, 141-169
Kittel A, Maas R, König J, Mieth M, Weiss N, Jarebska N, Hohenstein B, Martens-Lobenhoffer J, Bode-Böger S, Rodionov RN. In vivo evidence that Agxt2 can regulate plasma levels of dimethylarginines in mice.
Biochem Biophys Res Commun, 2013, 430: 84-89
Fromm MF. Prediction of transporter-mediated drug-drug interactions using endogenous compounds.
Clin Pharmacol Ther, 2012, 92: 546-548
Strobel J, Mieth M, Endreß B, Auge D, König J, Fromm MF, Maas R. Interaction of the cardiovascular risk marker asymmetric dimethylarginine (ADMA) with the human cationic amino acid transporter 1 (CAT1).
J Mol Cell Cardiol, 2012, 53: 392-400
König J, Klatt S, Dilger K, Fromm MF. Characterization of ursodeoxycholic and norursodeoxycholic acid as substrates of the hepatic uptake transporters OATP1B1, OATP1B3, OATP2B1 and NTCP.
Basic Clin Pharmacol Toxicol, 2012, 111: 81-86
Zolk O*, Ott C*, Fromm MF, Schmieder RE. Effect of the rs168924 single-nucleotide polymorphism in the SLC6A2 catecholamine transporter gene on blood pressure in Caucasians.
J Clin Hypertens, 2012, 14: 293-298 (*authors contributed equally)
Mandery K, Balk B, Bujok K, Schmidt I, Fromm MF, Gläser H. Inhibition of hepatic uptake transporters by flavonoids.
Eur J Pharm Sci, 2012, 46: 79-85
Fahrmayr C, König J, Auge D, Mieth M, Fromm MF. Identification of drugs and drug metabolites as substrates of multidrug resistance protein 2 (MRP2) using triple-transfected MDCK-OATP1B1-UGT1A1-MRP2 cells.
Br J Pharmacol, 2012, 165: 1836-1847
Zolk O, Fromm MF. Drug transporter regulation in tumors by DNA methylation.
Genome Med, 2012, 4:10
Mandery K, Gläser H, Fromm MF. Interaction of innovative small molecule drugs used for cancer therapy with drug transporters.
Br J Pharmacol, 2012, 165: 345-362
König J, Fromm MF, Gläser H. The Role of ABCC family members in the disposition of endogenous compounds and drugs.
Chapter 8 of “The ABC Transporters of Human Physiology and Disease”, Eds. KJ Linton, IB Holland, World Scientific, 2011, 209-245
Klatt S, Fromm MF, König J. Transport-mediated drug-drug interactions with oral antidiabetic drugs.
Pharmaceutics, 2011, 3: 680-705
Solbach TF, Grube M, Fromm MF, Zolk O. Organic cation transporter 3: Expression in failing and nonfailing human heart and functional characterization.
J Cardiovasc Pharmacol, 2011, 58: 409-417
Mandery K, Sticht H, Bujok K, Schmidt I, Fahrmayr C, Balk B, Fromm MF, Gläser H. Functional and structural relevance of conserved positively charged lysine residues in organic anion transporting polypeptide 1B3.
Mol Pharmacol, 2011, 80: 400-406
Birkenfeld AL, Lee H-Y, Guebre-Egziabher F, Alves TC, Jurczak MJ, Jornayvaz FR, Zhang D, Hsiao JJ, Martin-Montalvo A, Fischer-Rosinsky A, Spranger J, Pfeiffer AF, Jordan J, Fromm MF, König J, Lieske S, Carmean CM, Weismann D, Knauf F, Irusta PM, De Cabo R, Helfand SL, Samuel VT, Shulman GI. Deletion of the mammalian INDY homolog mimics aspects of dietary restriction and protects against adiposity and insulin resistance in mice.
Cell Metab, 2011, 14: 184-195
Müller F, Fromm MF. Transporter-mediated drug-drug interactions.
Pharmacogenomics, 2011, 12: 1017-1037
Müller F, König J, Gläser H, Schmidt I, Zolk O, Fromm MF, Maas R. Molecular mechanism of renal tubular secretion of the antimalarial drug chloroquine.
Antimicrob Agents Chemother, 2011, 55: 3091-3098
König J, Gläser H, Keiser M, Mandery K, Klotz U, Fromm MF. Role of organic anion- transporting polypeptides for cellular mesalazine (5-aminosalicylic acid) uptake.
Drug Metab Dispos, 2011, 39: 1097-1102
Kindla J, Müller F, Mieth M, Fromm MF, König J. Influence of non-steroidal anti-inflammatory drugs on organic anion transporting polypeptide (OATP)1B1- and OATP1B3-mediated drug transport.
Drug Metab Dispos, 2011, 39: 1047-1053
Zolk O, Fromm MF. Transporter-mediated drug uptake and efflux: important determinants of adverse drug reactions.
Clin Pharmacol Ther, 2011, 89: 798-805
König J, Zolk O, Singer K, Hoffmann C, Fromm MF. Double-transfected MDCK cells expressing human OCT1/MATE1 or OCT2/MATE1: determinants of uptake and transcellular translocation of organic cations.
Br J Pharmacol, 2011, 163: 546-555
Kindla J, Rau TT, Jung R, Fasching PA, Strick R, Stoehr R, Hartmann A, Fromm MF, König J. Expression and localization of the uptake transporters OATP2B1, OATP3A1 and OATP5A1 in non-malignant and malignant breast tissue.
Cancer Biol Ther, 2011, 11: 584-591
Fromm MF, Kim RB; Editors, Drug transporters.
Handbook of Experimental Pharmacology 201, 2011
Michelon H, König J, Durrbach A, Quteineh L, Verstuyft C, Furlan V, Ferlicot S, Letierce A, Charpentier B, Fromm MF, Becquemont L. SLCO1B1 genetic polymorphism influences mycophenolic acid tolerance in renal transplant recipients.
Pharmacogenomics, 2010,11: 1703-1713
Poguntke M, Bikadi Z, Fromm MF, Zolk O. Drug transport by breast cancer resistance protein (BCRP, ABCG2).
Expert Opin Drug Metab Toxicol, 2010, 6: 1368-1384
Mandery K, Bujok K, Schmidt I, Keiser M, Siegmund W, Balk B, König J, Fromm MF, Gläser H. Influence of the flavonoids apigenin, kaempferol and quercetin on the function of organic anion transporting polypeptides 1A2 and 2B1.
Biochem Pharmacol, 2010, 80: 1746-1753
Fahrmayr C, Fromm MF, König J. Hepatic OATP and OCT uptake transporters: their role for drug-drug interactions and pharmacogenetic aspects.
Drug Metab Rev, 2010, 42: 380-401
Kraft ME, Gläser H, Mandery K, König J, Auge D, Fromm MF, Schloetzer-Schrehardt U, Welge-Lüßen U, Kruse FE, Zolk, O. The prostaglandin transporter OATP2A1 is expressed in human ocular tissues and transports the antiglaucoma prostanoid latanoprost.
Invest Ophthalmol Vis Sci, 2010, 51: 2504-2511
Gläser H, Mandery K, Sticht H, Fromm MF, König J. Relevance of conserved lysine and arginine residues in transmembrane helices for the transport activity of organic anion transporting polypeptide 1B3.
Br J Pharmacol, 2010, 159: 698-708
Werner U, Werner D, Heinbüchner S, Graf B, Ince H, Kische S, Thürmann P, König J, Fromm MF, Zolk O. Gender is an important determinant of the disposition of the loop diuretic torasemide.
J Clin Pharmacol, 2010, 50: 160 168
Mandery K, Bujok K, Schmidt I, Wex T, Treiber G, Malfertheiner P, Rau TT, Amann K U,Brune K, Fromm MF, Gläser H. Influence of cyclooxygenase inhibitors on the function of the prostaglandin transporter organic anion-transporting polypeptide 2A1 expressed in human gastroduodenal mucosa.
J Pharmacol Exp Ther, 2010, 332: 345-351
Birkenfeld AL, Jordan J, Hofmann U, Busjahn A, Franke G, Krüger N, Igel S, Mürdter T, Drescher S, Shi S, Engeli S, Schwab M, Eichelbaum M, Luft FC, Fromm MF. Genetic influences on the pharmacokinetics of orally and intravenously administered digoxin as exhibited by monozygotic twins.
Clin Pharmacol Ther, 2009, 86: 605-608
Bachmakov I, Gläser H, Endress B, Möhrl F, König J, Fromm MF. Interaction of beta-blockers with the renal uptake transporter OCT2.
Diabetes Obes Metab, 2009, 11: 1080-1083
Keskitalo J, Zolk O, Fromm MF, Kurkinen K, Neuvonen P, Niemi M. ABCG2 polymorphism markedly affects the pharmacokinetics of atorvastatin and rosuvastatin.
Clin Pharmacol Ther, 2009, 86: 197-203
Zolk O, Solbach TF, König J, Fromm MF. Functional characterization of the human organiccation transporter 2 variant p.270Ala>Ser
Drug Metab Dispos, 2009, 37: 1312-1318
Kindla J, Fromm MF, König J. In vitro evidence for the role of OATP and OCT uptake transporters in drug-drug interactions.
Expert Opin Drug Metab Toxicol, 2009, 5: 489-500
Zolk O, Solbach TF, König J, Fromm MF. Structural determinants of inhibitor interaction with the human organic cation transporter OCT2 (SLC22A2)
Naunyn-Schmiedeberg’s Arch Pharmacol, 2009, 379: 337-348
Oswald S*, König J*, Lütjohann D, Giessmann T, Kroemer HK, Rimmbach C, Rosskopf D, Fromm MF, Siegmund W. Disposition of ezetimibe is influenced by polymorphisms of the hepatic uptake carrier OATP1B1.
Pharmacogenet Genomics, 2008, 18: 559-568 (*authors contributed equally)
Bachmakov I, Gläser H, Fromm MF, König J. Interaction of oral antidiabetic drugs with hepatic uptake transporters: focus on OATPs und OCT1.
Diabetes, 2008, 57: 1463-1469
Solbach TF, Paulus B, Weyand M, Eschenhagen T, Zolk O, Fromm MF. ATP-binding cassette transporters in the human heart failure.
Naunyn-Schmiedeberg’s Arch Pharmacol, 2008, 377: 231-243.
Janke D, Mehralivand S, Strand D, Gödtel-Armbrust U, Habermeier A, Gradhand U, Fischer Ch,Toliat MR, Fritz P, Zanger UM, Schwab M, Fromm MF, Nürnberg P, Wojnowski L, Closs EI, Lang T. 6-Mercaptopurine and 9-(2-phosphonyl-methoxyethyl) adenine (PMEA) transport altered by two missense mutations in the drug transporter gene ABCC4.
Human Mutation, 2008, 29: 659-669
Gläser H, Fromm MF. Animal models and intestinal drug transport.
Expert Opin Drug Metab Toxicol, 2008, 4: 347-361
Werner D, Werner U, Meybaum A, Schmidt B, Umbreen S, Grosch A, Lestin HG, Graf B, Zolk O, Fromm MF. Determinants of steady-state torasemide pharmacokinetics: Impact of pharmacogenetic factors, gender and angiotensin II receptor blockers.
Clin Pharmacokinet, 2008, 47: 323-332
Dragonas C, Wagner JT, Heppner HJ, Bertsch T, Muhlberg W, Wicklein S, Pahl A, Diewald Ch, Bachmakov I, Sieber CC, Fromm MF. The association of ABCB1 polymorphisms and elevated serum digitoxin concentrations in geriatric patients.
Eur J Clin Pharmacol, 2008, 64: 367-372
Gradhand U, Lang T, Schaeffeler E, Glaeser H, Tegude H, Klein K, Fritz P, Jedlitschky G, Kroemer HK, Bachmakov I, Anwald B, Kerb R, Zanger UM, Eichelbaum M, Schwab M, Fromm MF. Variability in human hepatic MRP4 expression: influence of cholestasis and genotype.
Pharmacogenom J, 2008, 8: 42-52
Seithel A, Klein K, Zanger UM, Fromm MF, König J. Non-synonymous polymorphisms in the human SLCO1B1 gene: an in vitro analysis of SNP c.1929A>C.
Mol Genet Genomics, 2008, 279: 149-157
Seithel A, Gläser H, Fromm MF, König J. The functional consequences of genetic variations in transporter genes encoding human organic anion transporting polypeptide family members.
Expert Opin Drug Metab Toxicol, 2008, 4: 51-64
Eberl S*, Renner B*, Neubert A, Reisig M, Bachmakov I, König J, Dörje F, Mürdter TE, Ackermann A, Dormann H, Gassmann KG, Hahn EG, Zierhut S, Brune K, Fromm MF. Role of P-glycoprotein inhibition for drug interactions: evidence from in vitro and pharmacoepidemiologic studies.
Clin Pharmacokinet, 2007, 46: 1039-1049 (*authors contributed equally)
Gläser H, Fromm MF, König J. Transporters and Drugs – An Overview.
In Antitargets. Hrsg. Vaz RJ, Klabunde T. WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim 2008, 343-368
Igel S, Drescher S, Mürdter T, Hofmann U, Heinkele G, Tegude H, Glaeser H, Brenner SS, Somogyi AA, Omari T, Schäfer C, Eichelbaum M, Fromm MF. Increased absorption of digoxin from the human jejunum due to inhibition of intestinal transporter-mediated efflux.
Clin Pharmacokinet, 2007, 46: 777-785
Seithel A*, Eberl S*, Singer K, Auge D, Heinkele G, Wolf NB, Dörje F, Fromm MF, König J. The influence of macrolide antibiotics on the uptake of organic anions and drugs mediated by OATP1B1 and OATP1B3.
Drug Metab Dispos, 2007, 35: 779-786 (*authors contributed equally)
Gradhand U, Tegude H, Burk O, Fromm MF, König J. Functional analysis of the polymorphism -211C>T in the regulatory region of the human ABCC3 gene.
Life Sciences, 2007, 80: 1490-1494
Zolk O, Jacobi J, Pahl A, Fromm MF, Schmieder RE. MDR1 genotype-dependent regulation of the aldosterone system in humans.
Pharmacogenet Genomics, 2007, 17: 137-144
Thuerauf N, Fromm MF. The role of the transporter P-glycoprotein for disposition and effects of centrally acting drugs and for the pathogenesis of CNS diseases.
Eur Arch Psychiatry Clin Neurosci, 2006, 256: 281-286
Bachmakov I, Werner U, Endress B, Auge D, Fromm MF. Characterization of ß-adrenoceptor antagonists as substrates and inhibitors of the drug transporter P-glycoprotein.
Fundam Clin Pharmacol, 2006, 20: 273-282
König J, Seithel A, Gradhand U, Fromm MF. Pharmacogenomics of human OATP transporters.
Naunyn-Schmiedeberg’s Arch Pharmacol, 2006, 372: 432-443
Solbach TF, König J, Fromm MF, Zolk O. ATP-binding cassette transporters in the heart.
Trends Cardiovasc Med, 2006, 16: 7-15
Bortfeld M, Rius M, König J, Herold-Mende C, Nies AT, Keppler D. Human multidrug resistance protein ABCC11 (MRP8), an apical efflux pump for steroid sulfates, is an axonal protein of the central and peripheral nervous system.
Neuroscience, 2006, 137: 1247-1257
Bachmakov I, Rekersbrink, Hofmann U, Eichelbaum M, Fromm MF. Characterisation of (R/S)-propafenone and its metabolites as substrates and inhibitors of P-glycoprotein.
Naunyn-Schmiedeberg’s Arch Pharmacol, 2005, 371: 195-201
Niemi M, Kivistö KT, Hofmann U, Schwab M, Eichelbaum M, Fromm MF. Fexofenadine pharmacokinetics are associated with SLCO1B1 (encoding for OATP1B1) polymorphism.
Br J Clin Pharmacol, 2005, 59: 602-604
König J, Hartel M, Nies AT, Martignoni ME, Guo J, Büchler MW, Friess H, Keppler D. Expression and localization of multidrug resistance protein (ABCC) family members in pancreatic carcinoma.
Int J Cancer, 2005, 115: 359-367
Kopplow K, Letschert K, König J, Walter B, Keppler D. Human hepatobiliary transport of organic anions analyzed by quadruple-transfected cells.
Mol Pharmacol 2005, 68: 1031-1038
Bronger H, König J, Kopplow K, Steiner HH, Herold-Mende C, Keppler D, Nies AT. ABCC drug efflux pumps and OATP uptake transporters in human gliomas and the blood-tumor barrier.
Cancer Res 2005, 65: 11419-11428
